Famílias da tabela periódica
Uma das formas que os elementos químicos são organizados é através de famílias, que correspondem as sequências verticais da tabela periódica.
As 18 colunas da tabela agrupam os elementos de acordo com as semelhanças nas propriedades químicas.
Organizar os elementos químicos em famílias foi uma maneira prática de estruturar as várias informações encontradas e apresentá-las de maneira simples.
Para facilitar a localização de um elemento químico, as famílias foram designadas em números de 1 a 18 como vemos a seguir:
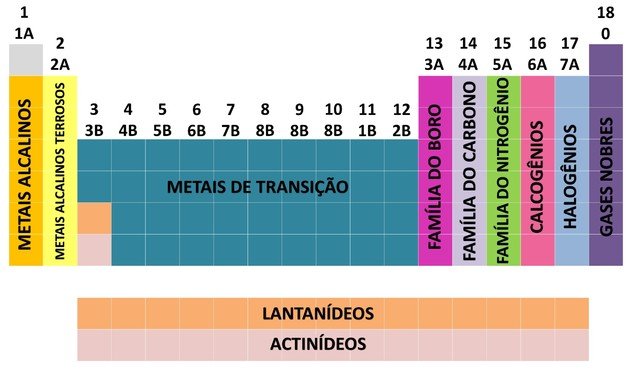
Pela contribuição de muitos cientistas e de várias tentativas de arranjar os dados, a tabela periódica evoluiu, estabelecendo uma ordem para dispor os elementos.
Nomenclatura das famílias
- As famílias da tabela foram divididas em A (representativos) e B (transição), sendo identificadas por letras e números.
- Os elementos representativos correspondem as famílias 0, 1A, 2A, 3A, 4A, 5A, 6A e 7A.
- Os elementos de transição correspondem as famílias 1B, 2B, 3B, 4B, 5B, 6B, 7B e 8B.
- Por determinação da União Internacional de Química Pura e Aplicada (IUPAC), as famílias passaram a ser identificadas em grupos de 1 a 18.
Tabela Periódica e distribuição eletrônica
As semelhanças entre os elementos de uma mesma família ocorrem porque o número de elétrons de valência do átomo no estado fundamental é o mesmo.
Por exemplo:
| Grupo 1 | Distribuição eletrônica |
|---|---|
| 3Li | 2-1 |
| 11Na | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
Os átomos do grupo 1 tem seus elétrons distribuídos por mais de um nível de energia, mas todos têm um elétron de valência.
Com isso, observamos que fazendo a distribuição eletrônica do átomo no estado fundamental, descobrimos a sua posição na tabela periódica.
Elementos representativos
Os elementos representativos apresentam um comportamento químico relativamente menos complexo que os elementos de transição e formam a maioria das substâncias que nos rodeiam.
Algumas das famílias de elementos representativos recebem nomes especiais, conforme vemos a seguir:
|
Grupo |
Família | Nome específico | Origem do nome | Elementos | Configuração eletrônica |
|---|---|---|---|---|---|
| 1 | 1A | Metais alcalinos | Do latim alcali, que significa “cinza de plantas”. | Li, Na, K, Rb, Cs e Fr |
ns1 |
| 2 | 2A | Metais alcalinoterrosos | O termo "terroso" refere-se a "existir na terra". | Be, Mg, Ca, Sr, Ba e Ra |
ns2 |
| 13 | 3A | Família do Boro | Nome do primeiro elemento da família. | B, Al, Ga, In, Tl e Nh. | ns2np1 |
| 14 | 4A | Família do Carbono | Nome do primeiro elemento da família. | C, Si, Ge, Sn, Pb e Fl. | ns2np2 |
| 15 | 5A | Família do Nitrogênio | Nome do primeiro elemento da família. | N, P, As, Sb, Bi e Mc. | ns2np3 |
| 16 | 6A | Calcogênios | Do grego khalkós, pois são elementos encontrados em minérios de cobre. | O, S, Se, Te, Po e Lv. | ns2np4 |
| 17 | 7A | Halogênios | Expressão grega que significa formadores de sais. | F, Cl, Br, I, At e Ts. | ns2np5 |
| 18 | 0 | Gases Nobres | Considerava-se que não reagia com outras substâncias. | He, Ne, Ar, Kr, Xe, Re e Og. |
1s2 (He) ou ns2np6 |
Através da tabela, podemos observar que:
- Os elementos apresentados acima são classificados em representativos por apresentarem o elétron mais energético em um subnível s ou p.
- Os elétrons distribuem-se por níveis de energia e n representa o nível mais externo do átomo no estado fundamental.
- Os elementos representativos, segundo a recomendação da IUPAC, pertencem aos grupos ou famílias 1,2,13,14,15,16,17 e 18.
O hidrogênio é classificado à parte dos outros elementos. Mesmo possuindo configuração eletrônica 1s1, ele não faz parte do grupo 1 por apresentar um comportamento singular.
Elementos de transição
Os elementos de transição correspondem aos grupos de 3 a 12. Recebem esse nome por possuírem características intermediárias entre os grupos 1 e 2 e os elementos representativos não metálicos.
Os metais de transição são definidos pela IUPAC como:
Um elemento de transição possui um subnível d incompleto ou pode formar cátions com um subnível d incompleto.
Quando o elétron mais energético do átomo no estado fundamental está em um subnível d incompleto, ele é caracterizado como de transição externa.
Os lantanídeos e os actinídeos são elementos de transição interna por possuir ao menos um subnível f incompleto.
Quando os elementos têm elétrons que preenchem os orbitais d ou f, eles exibem propriedades semelhantes e podem ser classificados em elementos de transição externa ou interna.
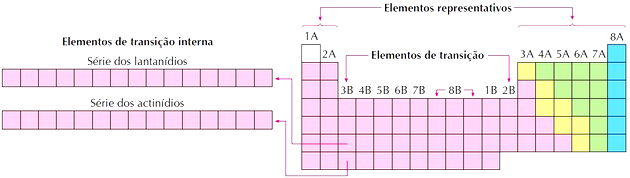
Como observamos na imagem, a família 8B corresponde a 3 colunas, são os grupos 8, 9 e 10, que foram agrupados assim por ter características próximas.
Leia também sobre Classificação Periódica dos Elementos.
Principais características das famílias
Na tabela abaixo, estão apresentadas as principais propriedades dos grupos da tabela periódica:
| Grupo | Características | Substâncias compostas mais comuns |
Ocorrências |
|---|---|---|---|
| 1 | Sólidos e brilhantes em condições ambientes. Muito reativos, macios e bons condutores de eletricidade. |
Sais, hidróxidos e óxidos |
Reagem com halogênios e formam sais. |
| 2 | Menos reativos e mais duros que o grupo 1. Sólidos prateados e com boa condutividade. |
Sais, hidróxidos e óxidos |
Formando sais e óxidos. |
| 3 a 12 | Formam complexos. São sólidos metálicos, duros e quebradiços, com exceção do mercúrio, que é líquido. | Sais, óxidos e complexos. Ex: AgNO3, TiO e [Cr(OH)3(H2O)3] |
Em minerais na forma de óxidos. |
| 13 | Sólidos em condições ambientes, prateados, exceto o boro. | Óxidos Ex: B2O3 |
Em minerais na forma de óxidos. |
| 14 | Sólidos em condições ambientes. | Átomos de C e Si podem se arranjar em cadeias e produzir uma enorme variedade de substâncias. | Em organismos vivos e na forma de silicatos ou óxidos. |
| 15 | Sólidos, exceto o nitrogênio, que se apresenta na forma gasosa em condições ambientes. | Óxidos e ácidos Ex: NO2 e H3PO4 |
Atmosfera, organismos vivos e minerais. |
| 16 | Sólidos, exceto o oxigênio, que se apresenta na forma gasosa em condições ambientes. | Sulfetos e óxidos Ex: ZnS e SiO2 |
Atmosfera, organismos vivos e minerais. |
| 17 | Formam moléculas diatômicas e são muito reativos. São maus condutores de eletricidade e calor. São agressivos para seres vivos e ambiente. | Ácidos e Sais. Ex: HCl e KBr |
Estão presentes em substâncias orgânicas e minerais. |
| 18 | São muito estáveis e encontrados na forma de gases. | Dificilmente formam substâncias compostas. | Gases na atmosfera. |
As propriedades químicas e físicas distinguem uma família de outra. Como vimos, as propriedades químicas estão relacionadas aos elétrons de valência, e através deles, um átomo interage com outro, sendo responsáveis pelo comportamento químico e ligações químicas formadas.
As propriedades físicas de elementos de um mesmo grupo podem variar de acordo com número atômico e massa.
Exercícios
Agora que você conheceu um pouco mais sobre as famílias da Tabela Periódica, teste seus conhecimentos e verifique o que aprendeu.
1) Considere o seguinte extrato da Tabela Periódica.
a) Indique dois elementos que tenham dois elétrons de valência.
b) Indique um elemento que reaja violentamente com a água, originando um hidróxido do metal.
c) Indique um elemento pouco reativo.
d) Indique dois elementos que se combinam com os metais alcalinos originando sais.
2) Na figura seguinte estão representados três elementos químicos, da esquerda para a direita, lítio, sódio e potássio.

Seleciona a opção que completa corretamente cada uma das afirmações seguintes.
1.1) “Podemos dizer que o lítio, o sódio e o potássio…
(A) … pertencem ao mesmo período.”
(B) … tem o mesmo número atômico.”
(C) … pertencem ao mesmo grupo.”
(D) … tem o mesmo número de massa.”
1.2) “Os elementos lítio, sódio e potássio…
(A) … tem propriedades químicas muito semelhantes.”
(B) … tem propriedades químicas muito diferentes.”
(C) … são não metais.”
(D) … reagem com a água originando soluções ácidas.”
3) Considere a tabela seguinte, onde estão representados os números atômicos e as distribuições eletrônicas de alguns elementos químicos.
| Elemento | Símbolo químico | Número atômico | Distribuição eletrônica |
|---|---|---|---|
| Lítio | Li | 3 | 2,1 |
| Berílio | Be | 4 | 2,2 |
| Flúor | F | 9 | 2,7 |
| Neônio | Ne | 10 | 2,8 |
| Cloro | Cl | 17 | 2,8,7 |
| Argônio | Ar | 18 | 2,8,8 |
| Potássio | K | 19 | 2,8,8,1 |
| Cálcio | Ca | 20 | 2,8,8,2 |
Indique o grupo de cada elemento.
Confira questões de vestibulares com resolução comentada em Exercícios sobre a Tabela Periódica e questões inéditas sobre o tema em Exercícios sobre Organização da Tabela Periódica.
Referências Bibliográficas
KOTZ, J. C.; TREICHEL JUNIOR, P. M. Química Geral e Reações Químicas. vol. 1, 5ª. ed., São Paulo: Pioneira Thomson, 2005.
BATISTA, Carolina. Famílias da tabela periódica. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/familias-da-tabela-periodica/. Acesso em:


