Grafeno
Grafeno é um nanomaterial composto apenas por carbono, em que os átomos se ligam formando estruturas hexagonais.
É o cristal mais fino conhecido e suas propriedades o fazem ser muito desejado. Esse material é leve, condutor de eletricidade, rígido e impermeável.
A aplicabilidade do grafeno está em diversas áreas. As mais conhecidas são: construção civil, energia, telecomunicações, medicina e eletrônica.
Desde que foi descoberto, o grafeno continua sendo o centro de interesse em pesquisas. O estudo de aplicações para esse material mobiliza instituições e investimentos de milhões de euros. Por isso, cientistas do mundo todo continuam tentando desenvolver uma forma mais barata de produzi-lo em grande escala.
Entendendo o que é o grafeno
Grafeno é uma forma alotrópica do carbono, onde o arranjo dos átomos desse elemento forma uma fina camada.
Esse alótropo é bidimensional, ou seja, possui apenas duas medidas: largura e altura.
Para se ter uma ideia do tamanho desse material, a espessura de uma folha de papel corresponde à sobreposição de 3 milhões de camadas de grafeno.
Embora seja o material mais fino isolado e identificado pelo homem, sua dimensão é da ordem de nanômetros. Ele é leve e resistente, capaz de conduzir eletricidade melhor que metais, como cobre e silício.
O arranjo que os átomos de carbono assumem na estrutura do grafeno, faz com que características muito interessantes e desejáveis possam ser encontradas nele.
Aplicações do grafeno
Muitas empresas e grupos de pesquisa espalhados pelo mundo estão a publicar resultados dos trabalhos envolvendo aplicações para o grafeno. Veja a seguir as principais delas.
| Água potável | Membranas formadas por grafeno são capazes de dessalinizar e purificar a água do mar. |
|---|---|
| Emissões de CO2 | Filtros de grafeno são capazes de reduzir as emissões de CO2 ao separar gases gerados por indústrias e comércios que serão rejeitados. |
| Detecção de doenças | Sensores biomédicos muito mais rápidos são feitos a base de grafeno e podem detectar doenças, vírus e outra toxinas. |
| Construção civil |
Materiais de construção, como betão e alumínio, se tornam mais leves e resistentes com a adição de grafeno. |
| Beleza | Coloração de cabelo pela pulverização de grafeno, cuja duração seria em torno de 30 lavagens. |
| Microdispositivos | Chips ainda menores e mais resistentes devido à substituição do silício pelo grafeno. |
| Energia | Células solares têm melhor flexibilidade, mais transparência e diminuição dos custos de produção com o uso de grafeno. |
| Eletrônicos | Baterias com melhor e mais rápido armazenamento de energia podem recarregar em até 15 minutos. |
| Mobilidade | Bicicletas podem ter pneus mais firmes e quadros pesando 350 gramas com o uso de grafeno. |
Estrutura do grafeno
A estrutura do grafeno é constituída por uma rede de carbonos ligados em hexágonos.
O núcleo do carbono é composto por 6 prótons e 6 nêutrons. Já os 6 elétrons do átomo estão distribuídos em duas camadas.
Na camada de valência há 4 elétrons, sendo que essa camada comporta até 8. Por isso, para o carbono adquirir estabilidade, deve fazer 4 ligações e atingir a configuração eletrônica de um gás nobre, conforme enuncia a regra do octeto.
Os átomos no grafeno se ligam por ligações covalentes, ou seja, há o compartilhamento de elétrons.
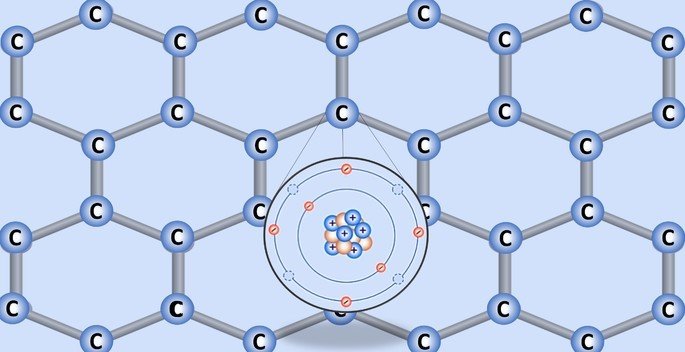
As ligações carbono-carbonos são as mais fortes encontradas na natureza e cada carbono se une à outros 3 na estrutura. Por isso, a hibridação do átomo é sp2, que corresponde a 2 ligações simples e uma dupla.

Dos 4 elétrons do carbono, três são compartilhados com os átomos vizinhos e um, que compõe a ligação , ajuda o grafeno, por exemplo, a ser um bom condutor de eletricidade porque tem mais "liberdade" no material.
Propriedades do grafeno
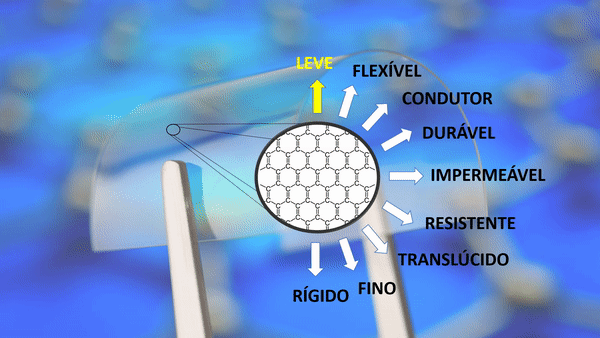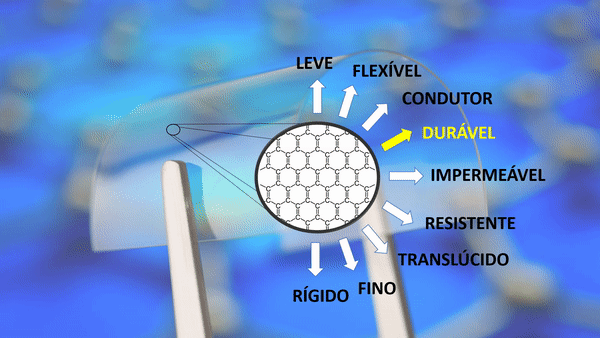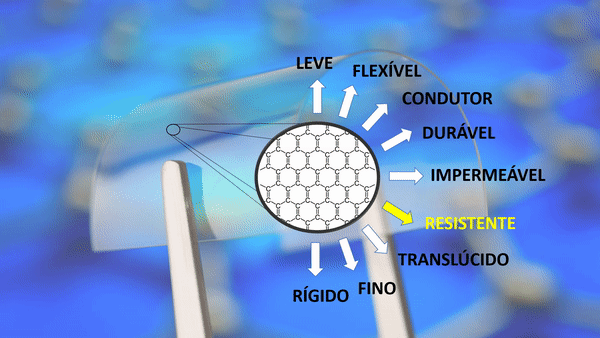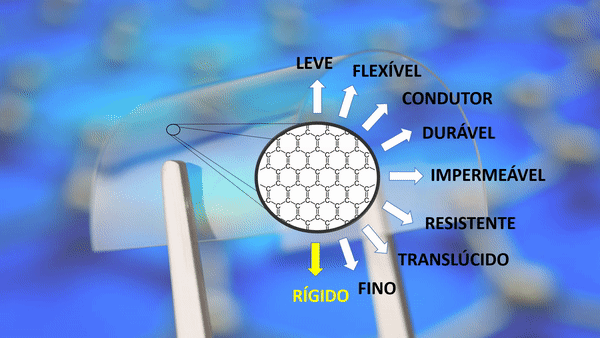
| Leve | Um metro quadrado pesa apenas 0,77 miligramas. Um aerogel de grafeno é cerca de 12 vezes mais leve que o ar. |
|---|---|
| Flexível | Ele pode expandir até 25% do seu comprimento. |
| Condutor |
Sua densidade de corrente superior à do cobre. |
| Durável | Ele se expande no frio e encolhe no calor. A maioria das substâncias agem de maneira oposta. |
| Impermeável | A malha formada por carbonos não permite nem mesmo a passagem de um átomo de hélio. |
| Resistente | Cerca de 200 vezes mais forte que o aço. |
| Translúcido | Absorve apenas 2,3% de luz. |
| Fino | Um milhão de vezes mais fino que um fio de cabelo humano. Sua espessura é de apenas um átomo. |
| Rígido | Material mais rígido conhecido, até mais que o diamante. |
História e descoberta do grafeno
O termo grafeno foi usado pela primeira vez em 1987, mas só foi reconhecido oficialmente em 1994 pela União de Química Pura e Aplicada.
Essa designação surgiu da junção do grafite com o sufixo -eno, fazendo referência à dupla ligação da substância.
Desde a década de 50, Linus Pauling falava em suas aulas da existência de uma camada fina de carbono, constituída de anéis hexagonais. Philip Russell Wallace também descreveu algumas importantes propriedades dessa estrutura anos antes.
Entretanto, apenas recentemente, em 2004, o grafeno foi isolado pelos físicos Andre Geim e Konstantin Novoselov na Universidade de Manchester e pode ser profundamente conhecido.
Eles estavam estudando o grafite e por meio da técnica de esfoliação mecânica conseguiram isolar uma camada do material com o uso de uma fita adesiva. Esse feito conferiu o Prêmio Nobel à dupla no ano de 2010.
Importância do grafeno para o Brasil
O Brasil tem uma das maiores reservas de grafita natural, material que contém grafeno. As reservas naturais de grafite chegam a 45% do total mundial.
Embora seja observada a ocorrência de grafita em todo território brasileiro, as reservas exploradas encontram-se em Minas Gerais, Ceará e Bahia.
Com a matéria-prima abundante, o Brasil também investe em pesquisas na área. O primeiro laboratório da América Latina destinado à pesquisas com grafeno está localizado no Brasil, na Universidade Presbiteriana Mackenzie em São Paulo, chamado de MackGraphe.
Fabricação do grafeno
O grafeno pode ser preparado a partir de carbeto, hidrocarboneto, nanotubo de carbono e grafite. Sendo esse último, o mais utilizado como material de partida.
Os principais métodos de produção de grafeno são:
- Microesfoliação mecânica: um cristal de grafite tem camadas de grafeno retiradas com uso de uma fita, que são depositas em substratos contendo óxido de silício.
- Microesfoliação química: as ligações dos carbonos são enfraquecidas pela adição de reagentes, rompendo parcialmente a rede.
- Deposição química a vapor: formação de camadas de grafeno depositadas em suportes sólidos, como superfície metálica de níquel.
Preço do grafeno
A dificuldade de sintetizar o grafeno em escala industrial faz com que o valor desse material ainda seja muito elevado.
Comparando com o grafite, seu preço chega a ser milhares de vezes maior. Enquanto 1 Kg de grafite é comercializado a 1 dólar, a venda de 150 g de grama de grafeno é feita por 15.000 dólares.
Curiosidades sobre o Grafeno
- Projeto da União Europeia, nomeado de Graphene Flagship, destinou cerca de 1,3 bilhão de euros para pesquisas relacionadas ao grafeno, aplicações e desenvolvimento de produção em escala industrial. Cerca de 150 instituições em 23 países participam desse projeto.
- A primeira mala desenvolvida para viagens espaciais possui grafeno em sua composição. Seu lançamento está previsto para 2033, quando a NASA pretende realizar expedições para Marte.
- Borofeno é o novo concorrente do grafeno. Esse material foi descoberto em 2015 e é tido como uma versão aperfeiçoada do grafeno, sendo ainda mais flexível, resistente e condutor.
Grafeno no Enem
Na prova do Enem 2018 uma das questões de Ciências da Natureza e Suas Tecnologias foi sobre o grafeno. Confira abaixo a resolução comentada dessa questão.
O grafeno é uma forma alotrópica do carbono constituído por uma folha planar (arranjo bidimensional) de átomos de carbono compactados e com a espessura de apenas um átomo. Sua estrutura é hexagonal, conforme a figura.
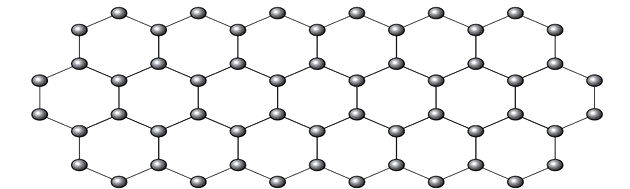
Nesse arranjo, os átomos de carbono possuem hibridação
a) sp de geometria linear.
b) sp2 de geometria trigonal planar.
c) sp3 alternados com carbonos com hibridação sp de geometria linear.
d) sp3d de geometria planar.
e) sp3d2 com geometria hexagonal planar.
Alternativa correta: b) sp2 de geometria trigonal planar.
A alotropia do carbono ocorre devido a sua capacidade de formar diferentes substâncias simples.
Por possuir 4 elétrons na camada de valência, o carbono é tetravalente, ou seja, tem a tendência de fazer 4 ligações covalentes. Essas ligações podem ser simples, dupla ou tripla.
Conforme as ligações que o carbono faz, muda-se a estrutura espacial da molécula para o arranjo que melhor acomoda os átomos.
A hibridação ocorre quando há a combinação dos orbitais, e para o carbono pode ser: sp, sp2 e sp3, dependendo do tipo de ligações.

O número de orbitais híbridos é a soma das ligações sigma (σ) que o carbono faz, pois a ligação não hibridiza.
- sp: 2 ligações sigma
- sp2: 3 ligações sigma
- sp3: 4 ligações sigma
A representação do alótropo grafeno em bolas e varetas, como mostra a figura da questão, não demonstra as verdadeiras ligações da substância.
Mas se observarmos uma parte da imagem, vemos que há um carbono, representando por bola, ligando-se a outros três carbonos formando uma estrutura como um triângulo.

Se o carbono precisa de 4 ligações e está ligado a outros 3 carbonos, então quer dizer que uma dessas ligações é dupla.
Por possuir uma ligação dupla e duas simples, o grafeno possui hibridação sp2 e, consequentemente, geometria trigonal planar.
As outras formas alotrópicas do carbono conhecidas são: grafite, diamante, fulereno e nanotubo. Embora todos sejam formados por carbono, os alótropos possuem propriedades diferentes, provenientes das suas diferentes estruturas.
Leia também: Química no Enem e Questões de Química no Enem.
BATISTA, Carolina. Grafeno. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/grafeno/. Acesso em:


