Ciências da natureza e suas tecnologias: Enem
A prova de Ciências da Natureza e suas Tecnologias do Enem é composta por 45 questões objetivas de múltipla escolha, valendo um total de 1000 pontos. Nela, são avaliados conhecimentos específicos de Biologia, Física e Química.
Veja a seguir uma lista e um pequeno resumo dos assuntos que envolvem os diferentes conteúdos que mais caem na prova de Ciências da Natureza e suas Tecnologias.
Biologia
Moléculas, células e tecidos
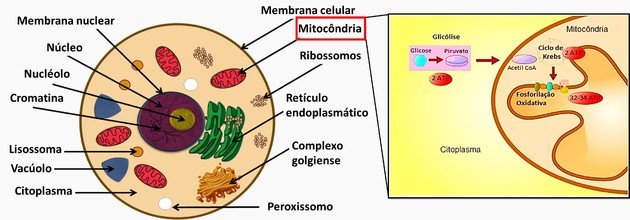
- Célula: Menor unidade dos seres vivos com formas e funções definidas.
- Teoria celular: Afirma que todos os seres vivos são formados por células.
- Organelas celulares: São como pequenos órgãos que realizam as atividades essenciais para as células.
- Núcleo celular: Onde se encontra o material genético (DNA) dos organismos e está presente nas células eucariontes.
- Divisão celular: Processo pelo qual uma célula-mãe origina células-filhas.
- Metabolismo: Conjunto de reações químicas que ocorre na célula e que lhe permite manter-se viva, crescer e se dividir.
- Síntese proteica: Mecanismo de produção de proteínas.
- Histologia: Estuda os tecidos biológicos analisando sua estrutura, origem e diferenciação.
- Citologia: Ramo da Biologia que estuda as células e suas estruturas.
- Biotecnologia: O uso das tecnologias para criar ou modificar organismos vivos.
Hereditariedade e diversidade da vida
- Hereditariedade: Mecanismo biológico onde as características de cada ser vivo são transmitidas de uma geração para outra.
- Genes e cromossomos: Os genes são minúsculas estruturas compostas de DNA. Por sua vez, o conjunto dessas estruturas formam os cromossomos.
- Leis de Mendel: São um conjunto de fundamentos que explicam o mecanismo da transmissão hereditária durante as gerações.
- Introdução à genética: Conceitos básicos da área da biologia que estuda os mecanismos da hereditariedade ou herança biológica.
- Variabilidade genética: Refere-se às variações dos genes entre indivíduos de uma população.
- Engenharia genética: Técnicas de manipulação e recombinação dos genes que reformulam, reconstituem, reproduzem e até criam seres vivos.
- Tipos sanguíneos: Os mais importantes são o Sistema ABO e o Fator Rh.
- Sistema ABO e Fator Rh: O sistema ABO classifica o sangue humano nos quatro tipos existentes: A, B, AB e O. Já o Fator Rh é um grupo de antígenos que determina se o sangue possui o Rh positivo ou negativo.
Identidade dos seres vivos
- Classificação dos seres vivos: Sistema que organiza os seres vivos em categorias de acordo com suas características comuns e relações de parentesco evolutivo.
- Vírus: São agentes infecciosos, microscópicos e acelulares (não possuem células).
- Células procariontes: Não possuem membrana nuclear nem estruturas membranosas no seu interior.
- Células eucariontes: É constituída de membrana plasmática, citoplasma e núcleo.
- Seres Autótrofos e Heterótrofos: Autótrofos são os seres vivos que obtêm nutrientes e energia, aproveitando a luz solar, através da fotossíntese, já os heterótrofos obtêm nutrientes e energia, consumindo outros seres vivos.
- Filogenia: É a história genealógica de uma espécie e de suas hipotéticas relações de ancestrais e descendentes.
- Embriologia: Estuda todas as fases do desenvolvimento embrionário desde a fecundação, formação do zigoto até que todos os órgãos do novo ser estejam completamente formados.
- Anatomia humana: Estuda as estruturas corporais, como elas se formam e como funcionam em conjunto no corpo (sistemas).
- Fisiologia: Estudo das múltiplas funções químicas, físicas e biológicas que garantem o adequado funcionamento dos organismos.
Ecologia e ciências ambientais
- Ecossistema: Conjunto formado por comunidades bióticas e fatores abióticos que interagem em uma determinada região
- Ecossistemas brasileiros: Os principais ecossistemas brasileiros são: Amazônia, Caatinga, Cerrado, Mata Atlântica, Mata dos Cocais, Pantanal, Mata de Araucárias, Mangue e Pampas.
- Fatores bióticos e abióticos: Os elementos físicos e químicos do ambiente (fatores abióticos) é que determinam, em larga escala, a estrutura e o funcionamento das comunidades vivas (fatores bióticos).
- Habitat e nicho ecológico: O habitat é local onde vive um animal e o nicho é a forma como ele vive ali.
- Teia alimentar: Conjunto de cadeias alimentares ligadas em um ecossistema.
- Cadeia alimentar: Corresponde à relação de alimentação, ou seja, à absorção de nutrientes e energia entre os seres vivos.
- Pirâmides ecológicas: São representações gráficas das interações tróficas entre as espécies em uma comunidade.
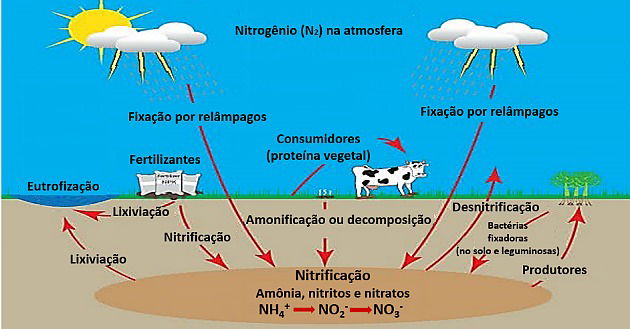
- Ciclos biogeoquímicos: Representam o movimento dos elementos químicos entre os seres vivos e a atmosfera, litosfera e hidrosfera do planeta.
- Biomas do Mundo: São sete os principais: Tundra, Taiga, Floresta Temperada, Floresta Tropical, Savanas, Pradaria e Deserto.
- Biomas brasileiros: São seis: Amazônia, Cerrado, Caatinga, Mata Atlântica, Pantanal e Pampa.
- Recursos naturais: São os elementos oferecidos pela natureza, que são utilizados pelo homem para sua sobrevivência.
- Mudanças climáticas: São as alterações do clima em todo o planeta.
- Efeito estufa e aquecimento global: O efeito estufa é processo natural que é intensificado pela ação humana e ocasiona o aquecimento global.
Origem e evolução da vida
- Origem da vida: Explicada por várias teorias desenvolvidas na busca por respostas.
- Abiogênese e biogênese: Duas teorias formuladas para explicar a origem da vida na Terra.
- O que é universo?: Corresponde ao conjunto de toda a matéria e energia existente.
- Teoria do Big Bang: Sustenta que o Universo surgiu a partir da explosão de uma única partícula - o átomo primordial - causando um cataclismo cósmico.
- Evolução: Corresponde ao processo de modificação e adaptação das espécies ao longo do tempo.
- Evolução humana: Corresponde ao processo de mudanças que originou os seres humanos e os diferenciou como uma espécie.
- Teoria da evolução: As espécies atuais descendem de outras espécies que sofreram modificações ao longo do tempo e transmitiram novas características aos seus descendentes.
- Darwinismo: É o conjunto dos estudos e teorias relativas à evolução das espécies, desenvolvidos pelo naturalista inglês Charles Darwin.
- Neodarwinismo: É a teoria moderna da evolução que está pautado nos estudos evolucionistas de Charles Darwin, unido às descobertas da genética.
- Seleção natural: Ocorre pela necessidade de sobrevivência e adaptação das espécies ao ambiente.
Qualidade de vida das populações humanas
- Índice de Desenvolvimento Humano (IDH): Avaliação do desenvolvimento da humanidade a partir de informações sobre a qualidade de vida e da economia de um território.
- Desigualdade social: Problema social em que há desproporcionalidade no padrão de vida dos habitantes.
- Produto Interno Bruto (PIB): Forma de mensurar a produção dentro de um certo período de tempo.
- DST - Doenças sexualmente transmissíveis: São doenças que podem ser transmitidas de uma pessoa para outra pelo contato sexual.
- Drogas: São substâncias que modificam as funções do organismo, bem como o comportamento das pessoas
- Gravidez na adolescência: É considerada a gravidez que ocorre entre os 10 e 19 anos, segundo a OMS.
- Problemas sociais do Brasil: Os principais são: desemprego, saúde, educação, moradia, violência e poluição.
- A importância da atividade física para a saúde: Melhora a qualidade de vida e, combinada com uma dieta balanceada, resulta em um organismo saudável, prevenindo doenças.
- Alimentação saudável: Consumo de alimentos com variedade, moderação e equilíbrio.
Questões de Biologia que caíram no Enem
1. (Enem/2016) As proteínas de uma célula eucariótica possuem peptídeos sinais, que são sequências de aminoácidos responsáveis pelo seu endereçamento para as diferentes organelas, de acordo com suas funções. Um pesquisador desenvolveu uma nanopartícula capaz de carregar proteínas para dentro de tipos celulares específicos. Agora ele quer saber se uma nanopartícula carregada com uma proteína bloqueadora do ciclo de Krebs in vitro é capaz de exercer sua atividade em uma célula cancerosa, podendo cortar o aporte energético e destruir essas células.
Ao escolher essa proteína bloqueadora para carregar as nanopartículas, o pesquisador deve levar em conta um peptídeo sinal de endereçamento para qual organela?
a) Núcleo.
b) Mitocôndria.
c) Peroxissomo.
d) Complexo golgiense.
e) Retículo endoplasmático.
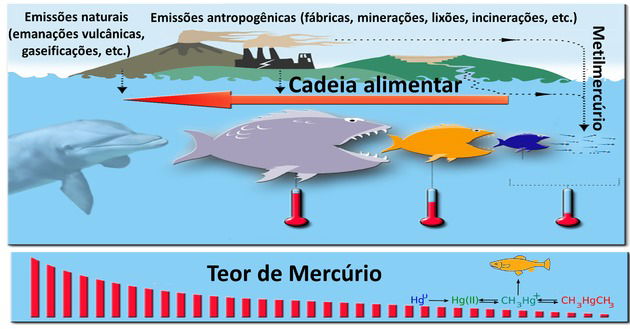
2. (Enem/2017) Os botos-cinza (Sotalia guianensis), mamíferos da família dos golfinhos, são excelentes indicadores da poluição das áreas em que vivem, pois passam toda a sua vida - cerca de 30 anos - na mesma região. Além disso, a espécie acumula mais contaminantes em seu organismo, como o mercúrio, do que outros animais da sua cadeia alimentar.
MARCOLINO, B. Sentinelas do mar. Disponível em: http://cienciahoje.uol.com.br. Acesso em: 1 ago. 2012 (adaptado).
Os botos-cinza acumulam maior concentração dessas substâncias porque:
a) são animais herbívoros.
b) são animais detritívoros.
c) são animais de grande porte.
d) digerem o alimento lentamente.
e) estão no topo da cadeia alimentar.
3. (Enem/2017) A Mata Atlântica caracteriza-se por uma grande diversidade de epífitas, como as bromélias. Essas plantas estão adaptadas a esse ecossistema e conseguem captar luz, água e nutrientes mesmo vivendo sobre as árvores.
Disponível em: www.ib.usp.br. Acesso em: 23 fev. 2013 (adaptado).
Essas espécies captam água do(a)
a) organismo das plantas vizinhas.
b) solo através de suas longas raízes.
c) chuva acumulada entre suas folhas.
d) seiva bruta das plantas hospedeiras.
e) comunidade que vive em seu interior.
Para mais questões comentadas de Biologia no Enem, preparamos essa lista: Questões de Biologia no Enem.
Física
Energia, trabalho e potência
- Trabalho na física: Transferência de energia devido à atuação de uma força.
- Energia: Representa a capacidade de produzir trabalho.
- Tipos de energia: Mecânica, térmica, elétrica, química e nuclear.
- Energia cinética: Energia associada ao movimento dos corpos.
- Energia potencial: Energia relacionada com a posição dos corpos.
- Força: Ação exercida sobre um corpo com capacidade de modificar o estado de repouso ou alterar a quantidade de movimento.
- Potência elétrica: Rapidez com que um trabalho é realizado.
- Potencial elétrico: Trabalho da força elétrica sobre uma carga eletrizada no deslocamento entre um ponto em relação a um ponto de referência.
- Fórmulas de física: Relações entre grandezas envolvidas em um mesmo fenômeno físico.
Mecânica, estudos dos movimentos e aplicações das leis de Newton
- Quantidade de movimento: Grandeza vetorial definida como o produto da massa de um corpo pela sua velocidade.
- Movimento uniforme: Representa o deslocamento de um corpo a partir de determinado referencial, sob velocidade constante.
- Movimento uniformemente variado: A velocidade é constante ao longo do tempo e é diferente de zero.
- Movimento retilíneo uniforme: O corpo está sob velocidade constante, contudo, a trajetória percorrida pelo corpo é em linha reta.
- Movimento retilíneo uniformemente variado: É realizado em linha reta e apresenta variação de velocidade sempre nos mesmos intervalos de tempo.
- Leis de Newton: Princípios fundamentais usados para analisar o movimento dos corpos.
- Gravidade: Força fundamental que regula objetos em repouso.
- Inércia: Propriedade da matéria que indica resistência à mudança.
Fenômenos ondulatórios e ondas
- Ondas: Perturbações que se propagam pelo espaço sem transporte de matéria, apenas de energia.
- Ondas mecânicas: Perturbações que transportam energia cinética e potencial através de um meio material.
- Ondas eletromagnéticas: Resultam da libertação das fontes de energia elétrica e magnética em conjunto.
- Ondas sonoras: São vibrações que produzem sensações auditivas ao penetrarem no nosso ouvido.
- Ondas gravitacionais: São ondulações na curvatura do espaço-tempo que se propagam pelo espaço.
Fenômenos elétricos e magnéticos
- Eletricidade: Área da Física que estuda os fenômenos causados pelo trabalho das cargas elétricas.
- Eletrostática: Estuda as cargas elétricas sem movimento, ou seja, em estado de repouso.
- Eletrodinâmica: Estuda o aspecto dinâmico da eletricidade, ou seja, o movimento constante das cargas elétricas.
- Eletromagnetismo: Estuda a relação entre as forças da eletricidade e do magnetismo como um fenômeno único.
- Processos de eletrização: Métodos onde um corpo deixa de ser eletricamente neutro e passa a estar carregado positivamente ou negativamente.
- Leis de Ohm: Determinam a resistência elétrica dos condutores.
- Leis de Kirchhoff: Determinam as intensidades das correntes em circuitos elétricos que não podem ser reduzidos a circuitos simples.
O calor e os fenômenos térmicos
- Calor e temperatura: O calor designa a troca de energia entre corpos, enquanto que a temperatura caracteriza a agitação das moléculas de um corpo.
- Propagação de calor: Transmissão de calor que pode ocorrer por meio de condução, convecção ou irradiação.
- Escalas termométricas: São usadas para indicar a temperatura, ou seja, a energia cinética associada à movimentação das moléculas.
- Calorimetria: Estuda os fenômenos relacionados às trocas de energia térmica.
- Calor específico: Grandeza física relacionada com a quantidade de calor recebida e a sua variação térmica.
- Calor sensível: Grandeza física que está relacionada com a variação da temperatura de um corpo.
- Calor latente: Grandeza física que designa a quantidade de calor recebida ou cedida por um corpo enquanto seu estado físico se modifica.
- Capacidade térmica: Grandeza que corresponde à quantidade de calor presente num corpo em relação à variação de temperatura sofrida por ele.
- Termodinâmica: Área da Física que estuda as transferências de energia.
Óptica, fenômenos ópticos, refração da luz
- Luz: Onda eletromagnética sensível a olho nu.
- Refração da luz: Fenômeno óptico que ocorre quando a luz sofre mudança do meio de propagação.
- Reflexão da luz: Fenômeno óptico da incidência de luz numa superfície refletora, retornando ao seu ponto de origem.
- Velocidade da luz: Velocidade com que a luz se desloca no vácuo e propagação em diferentes meios.
Hidrostática
- Hidrostática: Características dos fluidos como pressão hidrostática, densidade e força empuxo.
- Pressão hidrostática: Conceito e fórmulas para calcular a pressão hidrostática e a pressão total.
- Teorema de Stevin: Relação entre a variação das pressões atmosféricas e dos líquidos.
- Teorema de Arquimedes: Cálculo da força resultante exercida pelo fluido sobre determinado corpo (teorema do empuxo).
Questões de Física que caíram no Enem
1. (Enem/2017) Fusível é um dispositivo de proteção contra sobrecorrente em circuitos. Quando a corrente que passa por esse componente elétrico é maior que sua máxima corrente nominal, o fusível queima. Dessa forma, evita que a corrente elevada danifique os aparelhos do circuito. Suponha que o circuito elétrico mostrado seja alimentado por uma fonte de tensão U e que o fusível suporte uma corrente nominal de 500 mA.

Qual é o máximo valor de tensão U para que o fusível não queime?
a) 20 V
b) 40 V
c) 60 V
d) 120 V
e) 185 V
2. (Enem/2017) Em algumas residências, cercas eletrificadas são utilizadas com o objetivo de afastar possíveis invasores. Uma cerca eletrificada funciona com uma diferença de potencial elétrico de aproximadamente 10 000 V. Para que não seja letal, a corrente que pode ser transmitida através de uma pessoa não deve ser maior do que 0,01 A. Já a resistência elétrica corporal entre as mãos e os pés de uma pessoa é da ordem de 1 000 Ω.
Para que a corrente não seja letal a uma pessoa que toca a cerca eletrificada, o gerador de tensão deve possuir uma resistência interna que, em relação à do corpo humano, é
a) praticamente nula.
b) aproximadamente igual.
c) milhares de vezes maior.
d) da ordem de 10 vezes maior.
e) da rodem de 10 vezes menor.
3. (Enem/2017) Um motorista que atende a uma chamada de celular é levado à desatenção, aumentando a possibilidade de acidentes ocorrerem em razão do aumento de seu tempo de reação. Considere dois motoristas, o primeiro atento e o segundo utilizando o celular enquanto dirige. Eles aceleram seus carros inicialmente a 1,00 m/s2 . Em resposta a uma emergência, freiam com uma desaceleração igual a 5,00 m/s2 . O motorista atento aciona o freio à velocidade de 14,0 m/s, enquanto o desatento, em situação análoga, leva 1,00 segundo a mais para iniciar a frenagem.
Que distância o motorista desatento percorre a mais do que o motorista atento, até a parada total dos carros?
a) 2,90 m
b) 14,0 m
c) 14,5 m
d) 15,0 m
e) 17,4 m
Veja também: Física no Enem.
Química
Transformações químicas
- Transformações químicas: Ações que resultam na formação de novas substâncias
- Ligações químicas: Uniões entre os átomos de elementos iguais ou diferentes.
- Reações químicas: Rearranjo de átomos para formação de novas substâncias.
- Equilíbrio químico: Fenômeno que ocorre nas reações químicas reversíveis, quando a velocidade das reações direta e inversa se igualam.
- Modelos atômicos: Reúnem os modelos atômicos de Dalton, Thomson, Rutherford e Bohr.
- Estrutura atômica: Composta por três partículas fundamentais: prótons (com carga positiva), nêutrons (partículas neutras) e elétrons (com carga negativa).
- Elementos químicos: Elemento fundamental da matéria composto por grupo de átomos com mesmo número atômico.
- Tabela periódica: Classificação dos elementos químicos por ordem crescente de número atômico.
- Cálculos estequiométricos: Análise quantitativa da composição das substâncias consumidas e formadas em uma reação química.
Materiais, suas propriedades e usos
- Propriedades da matéria: Características físicas ou químicas que compõem os materiais.
- Estados físicos da matéria: Sólido, líquido, gasoso, plasma e condensado de Bose-Einstein.
- Mudanças de estado físico: São a condensação ou liquefação, solidificação, fusão, vaporização e sublimação.
- Íon, cátion e ânion: Íon é uma espécie química eletricamente carregada. Um cátion possui carga positiva, já um ânion apresenta carga negativa.
- Forças intermoleculares: São as forças exercidas para manter unidas duas ou mais moléculas.
- Molécula: É um grupamento estável de dois ou mais átomos iguais ou diferentes unidos através de ligações covalentes.
- Geometria molecular: É a forma que demonstra como os átomos se dispõem numa molécula.
- Fórmula molecular: É a expressão de símbolos químicos e índices dos componentes de uma molécula.
- Fórmula estrutural: Representa a forma como os átomos se ligam.
Água
- Água: Um dos recursos naturais mais importantes para a humanidade. É composta por um átomo de oxigênio e dois átomos de hidrogênio.
- Propriedades da água: É um excelente solvente, porque é capaz de dissolver uma enorme quantidade de substâncias.
- Densidade da água: É de 1 g/cm3 (lê-se: um grama por centímetro cúbico). Esse valor corresponde à água em 25 ºC.
- A importância da água: A água é a fonte de vida do planeta. Nesse sentido, quando falta água, a vida está ameaçada.
- Estados físicos da água: É encontrada na natureza em três estados físicos: líquido, sólido e gasoso.
Soluções químicas
- Soluções químicas: São misturas homogêneas formadas por duas ou mais substâncias.
- Soluções coloidais: São misturas que apresentam aspecto de uma mistura homogênea devido o tamanho das partículas dispersas estar entre 1 e 100 nm.
- Solubilidade: É a propriedade física das substâncias de se dissolverem, ou não, em um determinado líquido.
- Concentração de soluções: Corresponde à quantidade de soluto presente em uma determinada quantidade de solvente.
- Diluição de soluções: Consiste em adicionar solvente a uma solução, sem modificar a quantidade de soluto.
Compostos e substâncias químicas
- Ácidos: São substâncias que liberam íons positivos de hidrogênio ou prótons numa solução aquosa.
- Bases: São substâncias formadas pela união de um cátion e um ânion, que liberam íons hidroxila (ânions OH–) numa solução aquosa.
- Sais: Sais são o resultado da reação de um ácido com uma base.
- Óxidos: São compostos binários iônicos ou moleculares, donde as moléculas de oxigênios são ligados a outros elementos.
Transformações químicas e energia
- Termoquímica: É a parte da química que estuda o envolvimento da quantidade de calor (energia) nas reações químicas.
- Reações endotérmicas e exotérmicas: Quantidade de calor absorvida ou liberada durante as reações químicas.
- Entalpia: É a energia trocada nas reações de absorção e de liberação de energia.
- Lei de Hess: A variação de entalpia (ΔH) em uma reação química depende apenas dos estados inicial e final da reação, independente do número de reações.
- Eletroquímica: É a área da Química que estuda as reações que envolvem a transferência de elétrons e a interconversão de energia química em energia elétrica.
- Eletrólise: Reação química não espontânea que envolve uma reação de oxirredução, a qual é provocada por uma corrente elétrica.
- Lei de Faraday: Quando houver variação do fluxo magnético através de um circuito, surgirá nele uma força eletromotriz induzida.
- Radioatividade: Fenômeno nuclear que resulta da emissão de energia por átomos, provocada em decorrência de uma desintegração ou instabilidade de elementos químicos.
- Fissão nuclear: É o processo de divisão do núcleo atômico instável em outros núcleos mais estáveis.
- Fusão nuclear: É a junção de átomos que têm núcleos leves. Da junção desses átomos, resulta um átomo com núcleo mais pesado.
Compostos de carbono
- Química orgânica: Ramo da Química que estuda os compostos carbônicos, que são aqueles formados por átomos de carbono.
- Funções orgânicas: Classificação dos grupos de compostos orgânicos com características semelhantes.
- Cadeias carbônicas: Estrutura dos compostos orgânicos de acordo com o arranjo dos átomos e ligações.
- Hidrocarbonetos: Compostos formados por carbono e hidrogênio, com fórmula geral CxHy.
- Química inorgânica: Ramo da Química que estuda as substâncias formadas por elementos químicos, exceto o carbono.
- Funções inorgânicas: Grupos de compostos inorgânicos que apresentam características semelhantes.
Relações da química com as tecnologias, a sociedade e o meio ambiente
- Poluição: Introdução de substâncias ou energia de forma acidental ou intencional no meio ambiente, com consequências negativas para os seres vivos.
- Tipos de poluição: Os tipos dependem do recurso afetado e do tipo de lixo gerado, sendo os principais: do ar, do solo, da água, térmica, sonora, luminosa, visual e radioativa.
- Camada de ozônio: É uma cobertura de gás ozônio presente na estratosfera, que protege o planeta das radiações ultravioletas prejudiciais aos seres vivos.
- Lixo industrial: É proveniente dos processos desenvolvidos nas indústrias, ou seja, do setor secundário.
Energias químicas no cotidiano
- Petróleo: Substância natural composta por vários componentes orgânicos, especialmente, hidrocarbonetos.
- Gás natural: É originado na degradação da matéria orgânica, em jazidas subterrâneas misturado ou não ao petróleo. É composto por uma mistura de metano, em maior quantidade, e outros alcanos, além de CO2, H2S e N2.
- Carvão mineral: É um recurso natural não renovável originado de restos de plantas ao longo de milhões de anos.
- Combustíveis fósseis: São recursos naturais não renováveis, originados de restos orgânicos acumulados na crosta terrestre ao longo de milhões de anos.
- Biomassa: É toda matéria orgânica, de origem vegetal ou animal, utilizada na produção de energia.
- Biocombustíveis: É todo material utilizado para geração de energia a partir de biomassa orgânica.
- Energia renovável: É a energia obtida de fontes que se regeneram espontaneamente ou através da intervenção adequada do homem.
Questões de Química que caíram no Enem
1. (Enem/2016) Em meados de 2003, mais de 20 pessoas morreram no Brasil após terem ingerido uma suspensão de sulfato de bário utilizada como contraste em exames radiológicos. O sulfato de bário é um sólido pouquíssimo solúvel em água, que não se dissolve mesmo na presença de ácidos. As mortes ocorreram porque um laboratório farmacêutico forneceu o produto contaminado com carbonato de bário, que é solúvel em meio ácido. Um simples teste para verificar a existência de íons bário solúveis poderia ter evitado a tragédia. Esse teste consiste em tratar a amostra com solução aquosa de HCl e, após filtrar para separar os compostos insolúveis de bário, adiciona-se solução aquosa de H2SO4 sobre o filtrado e observa-se por 30 min.
TURBINO, M.; SIMONI, J.A. Refletindo sobre o caso Celobar®. Química Nova, n. 2, 2007 (adaptado).
A presença de íons bário solúveis na amostra é indicada pela
a) liberação de calor.
b) alteração da cor para rosa.
c) precipitação de um sólido branco.
d) formação de gás nitrogênio.
e) volatilização de gás cloro.
Veja também: Química no Enem.
2. (Enem/2017) Uma grande virada na moderna história da agricultura ocorreu depois da Segunda Guerra Mundial. Após a guerra, os governos haviam se deparado com um enorme excedente de nitrato de amônio, ingrediente usado na fabricação de explosivos. A partir daí as fábricas de munição foram adaptadas para começar a produzir fertilizantes tendo como componente principal os nitratos.
SOUZA, F. A. A agricultura natural/orgânica como instrumento de fixação biológica e manutenção do nitrogênio no solo: um modelo sustentável de MDL. Disponível em: www.planetaorganico.com.br. Acesso em: 17 jul. 2015 (adaptado).
No ciclo natural do nitrogênio, o equivalente ao principal componente desses fertilizantes industriais é produzido na etapa de
a) nitratação.
b) nitrosação.
c) amonificação.
d) desnitrificação.
e) fixação biológica do N2.
3. (Enem/2017) Um fato corriqueiro ao se cozinhar arroz é o derramamento de parte da água de cozimento sobre a chama azul do fogo, mudando-a para uma chama amarela. Essa mudança de cor pode suscitar interpretações diversas, relacionadas às substâncias presentes na água de cozimento. Além do sal de cozinha (NaCl), nela se encontram carboidratos, proteínas e sais minerais.
Cientificamente, sabe-se que essa mudança de cor da chama ocorre pela
a) reação do gás de cozinha com o sal, volatizando gás cloro.
b) emissão de fótons pelo sódio, excitado por causa da chama.
c) produção de derivado amarelo, pela reação com o carboidrato.
d) reação do gás de cozinha com a água, formando gás hidrogênio.
e) excitação das moléculas de proteínas, com formação de luz amarela.
Para mais questões comentadas de Química no Enem, preparamos essa lista: Questões de Química no Enem.
Quiz Enem: Ciências da Natureza
Leia também sobre:
- Questões Enem
- Simulado Enem (questões comentadas por especialistas)
- Ciências Humanas e suas tecnologias
- Linguagens, códigos e suas tecnologias
- Assuntos que mais caem no Enem
- Mini simulado Enem: Ciências da Natureza
Referências Bibliográficas
ENEM 2016 – Exame Nacional do Ensino Médio. INEP - Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira. Ministério da Educação.
ENEM 2017 – Exame Nacional do Ensino Médio. INEP - Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira. Ministério da Educação.
ENEM, MATRIZ DE REFERÊNCIA. Ministério da Educação Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira. 2013.
DIANA, Juliana. Ciências da natureza e suas tecnologias: Enem. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/ciencias-da-natureza-e-suas-tecnologias/. Acesso em: